无机化学论文:放射化学中石墨炔的初步结果和应用展望
摘 要: 石墨炔作为一种新型的二维碳材料,自2010年首次合成后即得到了广泛的关注和研究。目前石墨炔在储能、催化、电化学、医药和吸附等领域已经展现出广阔的应用前景。石墨炔具有特殊三角孔洞结构和大π键特性,对不同离子具有选择性吸附潜力,在放射化学领域有着潜在的应用价值。之前的工作表明,石墨炔在镧锕分离、钍铀分离、锶铯分离中具有显着的效果。与此同时,锕系离子被石墨炔吸附后呈现单离子态。石墨炔的π体系与锕系单离子的5f电子之间发生强烈的键合作用。而5f电子的反馈作用对锕系离子的选择性分离至关重要。本文首先对石墨炔的合成、性质、应用进行简短的综述,进而对石墨炔在放射化学领域中的初步结果进行介绍,最后对石墨炔在放射化学领域的应用进行了展望。
关键词: 石墨炔; 放射化学; 离子选择性分离; 锕系单离子;
Abstract: As a new type of two-dimensional carbon material, graphdiyne has received extensive attention and research since it was first synthesized in 2010. Graphdiyne has been widely used in the fields such as energy storage, catalysis, electrochemistry, medicine and adsorption. Due to the special triangular pore structure and large π bond characteristics, graphdiyne has the potential for selective adsorption of different ions, so the application of graphdiyne in the field of radiochemistry is greatly expected. It was shown that graphdiyne has obvious effects on the separation between lanthanides and actinides, thorium and uranium as well as strontium and cesium. At the same time, it was found that the actinides ions adsorbed on the graphdiyne are in single ion state. The π system of graphdiyne strongly interacts with the 5 f electrons of actinides single ions, which feed back to graphdiyne playing an essential role in the selective adsorption. This review briefly summarizes the synthesis, properties and application fields of graphdiyne. After that, this review introduces the recent progress of graphdiyne in radiochemistry. At last, this review prospects the application of graphdiyne in radiochemistry based on the existing research.
Keyword: graphdiyne; radiochemistry; ion selective separation; actinide single ion;
石墨炔是一种新型的二维碳材料,其基本结构由Baughman[1]在1987年首次提出。但是由于sp键的高合成能和柔性导致其合成较为困难。石墨炔是一类由—C≡C—链接两个相邻的sp2杂化的C原子而构成的物质的统称,其基本结构为苯环各个取代位点通过多个—?≡C-链接构成的平面。根据链接的—C≡C—的数量可以分为石墨(单)炔(graphyne)、石墨二炔(graphdiyne,简称GDY)、石墨三炔(graphtriyne)等(图1)。2010年李玉良课题组[2]使用六乙炔基苯单体在铜箔上通过Glaser偶联反应制备了第一例石墨二炔薄膜。由于石墨二炔是目前合成的唯一石墨炔材料,现阶段的研究均以石墨二炔为重点。此后研究人员对石墨炔进行了近十年的系统研究。石墨炔具有丰富的碳化学键、大共轭体系、多活性位点、特殊三角孔道结构以及优良的化学稳定性,在诸如电化学[3]、储能材料[4,5]、催化[6]等领域均有着重要的应用前景。Gao等[7]针对石墨炔的合成、特点以及应用进行了详细的综述。对石墨炔结构特征的深入探究及对其应用领域的不断拓展,都将对石墨炔研究起重要的推动作用。本文首先针对石墨炔的合成、物性和应用领域进行综述,进而介绍其在放射化学领域的初步研究结果,为石墨炔在放射化学领域的应用提供思路。
图1 石墨炔结构示意图
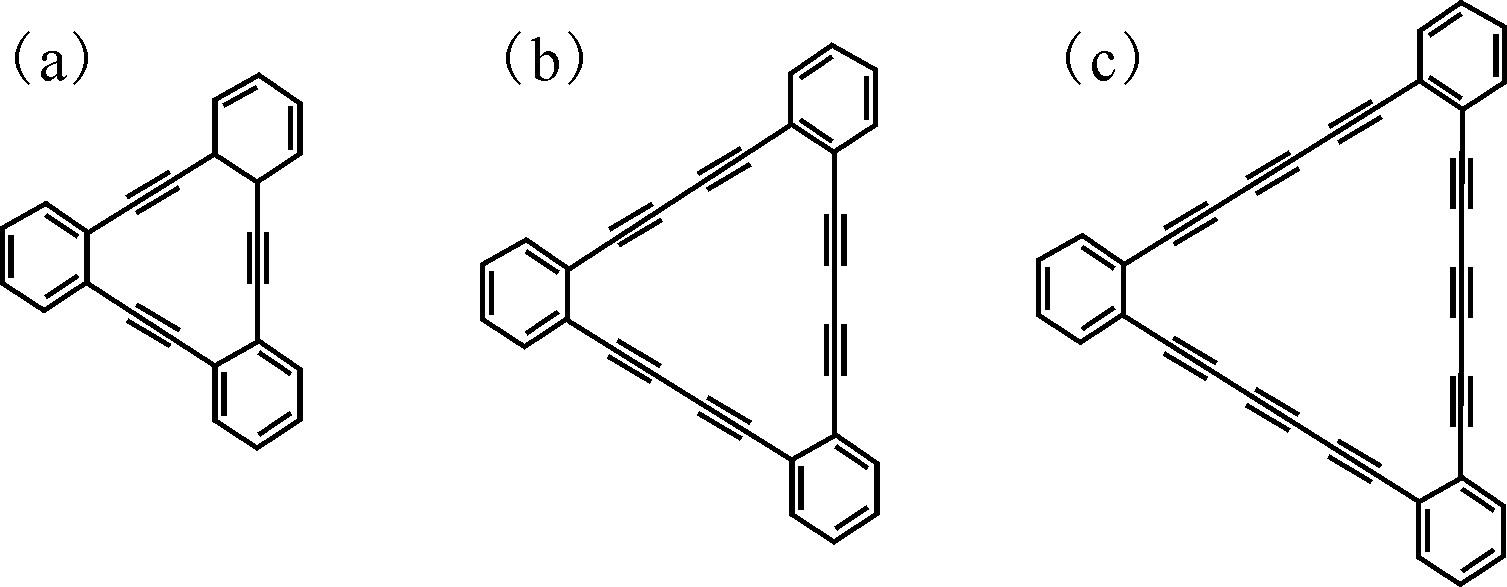
Fig.1 Scheme of structures of graphyne, graphdiyne, and graphtriyne
(a)——石墨单炔,(b)——石墨二炔,(c)——石墨三炔
1 、石墨炔的合成方法和物化性质
1.1 、石墨炔合成方法
1.1.1 、铜基底生长法
2010年李玉良课题组[2]以铜箔为基底和催化剂,以六乙炔基苯为反应单体,通过Glaser偶联反应合成了首例石墨炔材料。但铜箔表面释放出的铜离子由于梯度浓度的影响,致使催化剂不能完全保留在铜箔的表面上。因此,该方法不可避免地发生单体的液相聚合,且不能产生理想的二维材料。在这之后,Zhou等[8]在李玉良课题组的方法基础上进一步优化了合成石墨炔的反应条件,在铜箔上制备出了石墨炔纳米墙结构(图2)。该方法利用丙酮代替吡啶作为反应溶剂,通过调节反应体系中有机碱(吡啶和四甲基乙二胺)和单体的用量,成功地在铜箔表面制备出均匀连续的石墨炔纳米墙。原子力显微镜表征表明,这种纳米墙是层状结构,厚度范围从几纳米到几十纳米,并且实验证明石墨炔纳米墙是平整且连续的。
图2 石墨炔合成示意图[8]
![图2 石墨炔合成示意图[8]](/uploads/allimg/210323/1349211I1-1.jpg)
Fig.2 Scheme of synthesis of GDY[8]
1.1.2 、界面生长法
虽然已经通过实验得到了大面积连续的石墨炔结构,但合成结晶度高的薄层石墨炔依然具有重要意义。Matsuoka等[9]为研究这一问题尝试在液-液界面和气-液界面合成薄层石墨炔。在他们的实验中将六乙炔基苯和Cu(OAc)2分别溶解在两相溶剂中,在较低的单体浓度下,通过在液-液界面处进行Eglinton偶联反应,成功获得了厚度为24 nm的石墨炔薄膜。同时,他们还通过在Cu(OAc)2的水溶液上喷射微量的六乙炔基苯的二氯甲烷溶液使单体偶联反应限制在气-液界面进行,在气-液界面处可以获得平均厚度仅为3 nm、平均尺寸为1.5 mm的六方晶态石墨炔纳米片。通过上述界面生长法实现了高质量石墨炔薄膜和纳米片的制备,为研究石墨炔的理化性质奠定了基础。
1.1.3 、爆炸合成法
为了实现石墨炔的简单宏量制备,李玉良课题组[10]提出了爆炸法。这一方法通过在给定的N2或空气条件下对六乙炔基苯进行简单加热,无需加入任何额外催化剂,就可发生偶联反应。同时通过简单调整热处理过程中参数,可以有效控制石墨炔粉末的微观形态(图3),最终,合成出具有不同形貌的石墨炔。这种爆炸法的特点是在制备全碳材料的过程中无需添加额外的金属催化剂,为石墨炔的宏量制备提供一种有效的方法。然而,与界面辅助合成法生长的石墨炔相比,爆炸法合成的石墨炔粉末结晶度明显较差。
图3 爆炸法合成石墨炔[10]
![图3 爆炸法合成石墨炔[10]](/uploads/allimg/210323/134921D04-2.jpg)
Fig.3 Explosion method for synthesis of grapydiyne[10]
(a)——六乙炔基苯单体,(b)——不同反应条件, (c)——反应得到的不同形貌石墨炔示意图, (d)——反应后体积变化
1.1.4 、辅助模板法
在构筑基于石墨炔功能器件时,通常需要将结构可控的石墨炔转移到特定基底上。然而,在复杂的转移过程中,很难使其结构保持稳定。因此,非常需要在目标基底上直接生长具有特定结构的石墨炔,从而探索其在不同领域的特殊应用。李玉良课题组[11]报道了一种通过氧化铝模板合成石墨炔纳米管的方法。实验表明该石墨炔纳米管具有较高的场发射性能。Gao等[12]提出了一种在任意基底上合成石墨炔纳米墙的简单方法。在该方法中,目标基底置于由铜箔折叠的封套中,再将封套放入含有单体、丙酮、吡啶和四甲基乙二胺的混合溶液中。在碱性条件下,外层的铜封套可以溶解释放出铜离子,从而催化单体在基底上进行原位生长。Zhao等[13]则开发了另一种在任意基底上合成石墨炔的方法。他们使用PVP/Cu(OAc)2复合膜代替铜作为催化剂来源,铜离子可以从复合膜中逸出到目标基底(例如 SiO2、ZnO、Al等)的表面上,从而诱导石墨炔在目标基底上原位生长。
1.1.5、 液相范德华外延合成法
近年来,尽管研究人员在高质量石墨炔薄膜的合成方面取得了相当大的进展,但大多数报道的方法仍然无法制造大面积的少层或单层石墨炔薄膜。为了解决这一难题,Gao等[14]提出一种简单的液相范德华外延的方法,成功在石墨烯基底上生长出二维的超薄单晶石墨炔膜。在这一方法中首先选择具有较高对称性的六乙炔基苯分子作为单体。为了保持反应过程中单体溶液的稳定性,将单体溶液浓度(0.04 mmol/L)保持在较低的水平。其次,利用Eglinton偶联反应使六乙炔基苯中的炔键可以相互连接,即使在较低的单体浓度下,石墨炔膜在室温下也能有效地缓慢生长。最后,石墨烯用作外延衬底以限制单体中炔烃基与苯环之间桥连的单键自由旋转。通过单体与石墨烯之间的 π-π 和范德华力的相互作用限制石墨炔在二维石墨烯平面中的生长。
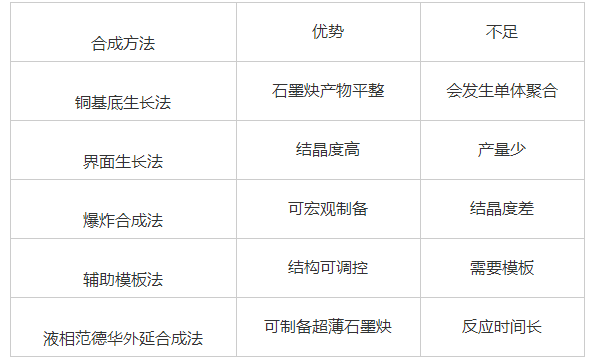
不同石墨炔的合成方法比较列于表1。
表1 不同石墨炔合成方法对比
1.2 、石墨炔基本理化性质
1.2.1、 力学性质
石墨炔具有特殊的孔结构,研究其在力学上的性质具有很大意义。文献[15]用分子动力学方法研究了石墨炔的力学性质,比较了不同石墨炔的断裂应力和应变。研究发现:炔键的存在对石墨炔的力学性能有重要影响;随着炔键的百分比增加,石墨炔的断裂应力相应降低;相反的是石墨炔中的炔键会产生柔韧性,从而相应地增强断裂应变。
1.2.2 、电子学特性
不同的层数和不同的堆叠方法均影响石墨炔层状材料的电子性能。Zheng等[16]使用密度泛函理论(density functional theory, DFT)研究了石墨炔的不同堆积行为和相关的电子性质(带隙和迁移率)。结果表明,在Bernal模式下苯环的堆积最大。双层和三层石墨炔为稳定堆叠模式。双层石墨炔和三层石墨炔的最稳定结构的带隙分别为0.35 eV和0.33 eV,两者均小于单层石墨炔的本征带隙。值得注意的是,当双层和三层石墨炔材料分别显示AA和AAA堆叠模式时,它们表现出金属特性。Matsuoka等[9]提出了石墨炔的另一种叠加模型。他们使用杂化泛函HSE06预测了单层、双层(AB堆叠)和三层(ABC堆叠)石墨炔的能带结构和能带隙(Eg)。随着石墨炔层数的增加,石墨炔的带隙减小,但直接带隙得以保留。实验上,他们用ABC堆叠测量了三层石墨炔的光致发光光谱,观察到一个单一的发射峰,该峰在光子能量处最大为1.79 eV,接近三层石墨炔的预测带隙。Muz等[17]使用DFT理论和长程修正电荷自洽密度泛函紧束缚理论(long-range corrected self-consistent charge density-functional based tight-binding,LC-SCC-DFTB)研究了石墨氮掺杂石墨炔的结构、光学和反应性以及电子结构。计算表明,掺杂了氮的石墨炔的最大吸光度由1.91 eV(647 nm)变为1.46 eV(845 nm)、2.15 eV(576 nm)和1.21 eV(1 020 nm)。同时当增加氮含量和温度时,材料的偶极矩增加。 Li等[18]则通过DFT理论计算系统地研究了具有单个吸附碱金属原子的石墨炔的几何结构、电子性质、电荷转移和非线性光学响应。结果表明,具有单个吸附的碱金属原子的石墨炔具有设计成新型碳基非线性光学材料和传感装置的潜力。
1.2.3、 磁性质
由于自旋电子学具有广阔的发展前景,近年来,低维碳材料的内在磁性引起了很多关注。一般而言,二维碳材料中的空穴和sp3型缺陷被认为是引起磁性的主要原因,这将破坏离域的pi电子系统并防止sp3型官能团的聚集。石墨炔是一种窄带隙半导体材料,由sp和sp2杂化的碳原子组成,其独特的结构特征为防止sp3型功能团聚集提供了可能。Zheng等[19]首先研究了石墨炔的本征磁性。它具有自旋半顺磁性。利用DFT理论进一步研究了所制备的石墨炔的产生磁性。结果表明:石墨炔上的羟基是主要的磁源;石墨炔上的羟基具有比石墨烯更高的迁移阻挡能,这阻止了它们的聚集;石墨炔在600 ℃退火后变为反铁磁性。此外,Zhang等[20]发现通过掺杂N原子可以增强石墨炔的顺磁性,在氨气气氛下对石墨炔进行退火,观察到在2 K时石墨炔的饱和磁矩增加了两倍。文献[21]使用DFT理论研究了石墨炔上的单个3d过渡金属原子(V、Cr、Mn、Fe、Co和Ni)的电子和磁性。研究发现,电子结构过渡金属-石墨炔的特征对过渡金属的3d轨道的现场库仑能量值敏感。过渡金属原子的吸附可以有效地调节石墨炔系统的电子结构,并且还可以诱导得到更强的磁性能,例如自旋极化半导体的磁性能。产生的原因是在过渡金属原子与石墨炔膜之间存在电荷转移,过渡金属原子中s、p和d轨道的电子被重新分布,从而引起这种现象。
1.2.4、 石墨炔形变性质
在Li等[22]的研究中,通过DFT理论系统研究了吸附过渡金属原子后的石墨炔的电子结构和稳定性。研究表明,吸附了具有部分填充的3d轨道的过渡金属的石墨炔具有扭曲的面内共轭骨架,且随着3d轨道电子的增加这种形变趋势逐渐降低。Lu等[23]通过原位和频谱验证了吸附碱金属离子后的石墨炔中烯烃-炔烃复合物过渡效应,该效应可以对附加电场产生高效响应。在他们的研究中,与石墨炔结构配位的阳离子在外加电场作用下会导致烯烃-炔配合物的转换使得石墨炔的共价键网络发生尺寸上的变化。
2 、石墨炔的重要应用
2.1、 储能领域
石墨炔特殊的原子排列方式引起了一种独特三角构型的锂原子的配位模式,从而导致锂原子很好地分散在单层石墨炔的两侧。预测石墨炔单层的最大锂存储容量高达744 mA·h/g,是石墨锂存储容量的两倍。凭借其相当高的迁移率和锂存储容量,石墨炔可作为一种高效的锂离子电池负极材料。Huang等[24]已经利用石墨炔薄膜作为锂离子电池的负极材料成功获得了具有优良倍率性能(rate performance)、大功率、大电流、长效的循环稳定性的电池。2018年Shang等[25]实现了在铜纳米线上合成石墨炔纳米管和纳米片,该材料是大规模生产超薄石墨炔纳米结构的第一例,该样品可以弯曲且超轻,可用作锂离子电池阳极,且其存储Li+的性能十分优异。Zeng等[26]提出了一种使用二维(2D)石墨炔和非金属掺杂剂的新型碳电极。通过第一性原理计算,该工作系统地研究了B/N掺杂的石墨炔的结构、能量、电子和电容特性。结果表明,B/N掺杂将石墨炔从直接带隙半导体转变为优良金属。通过评估不同掺杂浓度的石墨炔的量子电容,证明了掺杂B/N的石墨炔作为阳极(阴极)的电容可以达到创纪录的4 317 F/g(6 150 F/g)。
2.2、 催化领域
Liu等[27]发现在石墨炔上等电子掺杂B和N原子可以稳定构象,改善带隙。N掺杂石墨炔可以充当优良的氧化还原反应的无金属电催化剂。N掺杂石墨炔具有优越的氧化还原电催化性能,其电催化活性可与用于碱性燃料电池氧化还原的商业Pt/C催化剂相比。在这种介质中,N掺杂石墨炔比Pt/C催化剂具有更好的稳定性和对交叉效应的耐受性。Yu等[28]合成了以石墨炔与二硫化钼为催化中心的复合材料用于各种pH值下的超高效释氢反应,实验结果表明,其可以明显提高释氢反应的活性,尤其是在碱性条件下其催化效率甚至优于铂碳电极。He等[29]通过从头计算法研究了掺杂了1~4个Fe原子的石墨炔对CO2电化学还原催化的活性和选择性。研究发现,Fe二聚体和Fe三聚体表现出最高的催化活性和选择性,表现优于迄今为止报道的许多催化剂;而且,可以通过控制Fe原子的数量显着调节催化活性和选择性,为电化学还原CO2的纳米催化剂设计开辟了新途径。
2.3 、太阳能领域
在太阳能领域,Li等[30]将石墨炔引入钙钛矿太阳能电池的FA0.85MA0.15Pb(I0.85Br0.15)3钙钛矿薄膜中,发现具有石墨炔的钙钛矿膜的光生载流子提取率和电子迁移率均由于石墨炔优异的导电能力而大大增加。该文还根据石墨炔的半导体特性和钙钛矿的能带结构,提出了石墨炔/钙钛矿异质结,它可以贡献额外的通道,以通过加速漂移和扩散能力来提高光生载流子的提取和传输,从而提高效率。同时,引入石墨炔可以有效地改善钙钛矿薄膜和器件的防潮稳定性。Gao等[31]在坚固的泡沫铜上合成了石墨炔/CuO的纳米线。这种结构在整个太阳光谱范围内显示出极好的太阳能吸收能力,并且具有用于蒸气流动的多孔网络。在1 kW·m2光照下,可以达到91%的光热效率。
2.4 、生物医药领域
对于石墨炔在生物领域的应用,Wang等[32]研究发现,石墨炔具有较高的荧光淬灭能力,可以用作荧光传感的新平台,其中石墨炔的氧化物比石墨炔具有更高的淬灭能力。进一步通过实验表明,石墨炔的氧化物可以对DNA和凝血酶进行有效的荧光传感。Parvin等[33]则合成了石墨炔纳米片用于荧光传感平台,该研究表明,石墨炔纳米片对单链DNA和双链DNA有着不同的亲和力,首次开发了基于石墨炔纳米片的多层DNA传感器。Liu等[34]合成了荧光石墨炔量子点,在许多有机溶剂和水中显示出优异的分散性。这项工作为制造基于石墨炔的生物传感器提供了可能(图4)。
图4 UV灯照射下分散在不同常用有机溶剂中的石墨炔量子点(a)
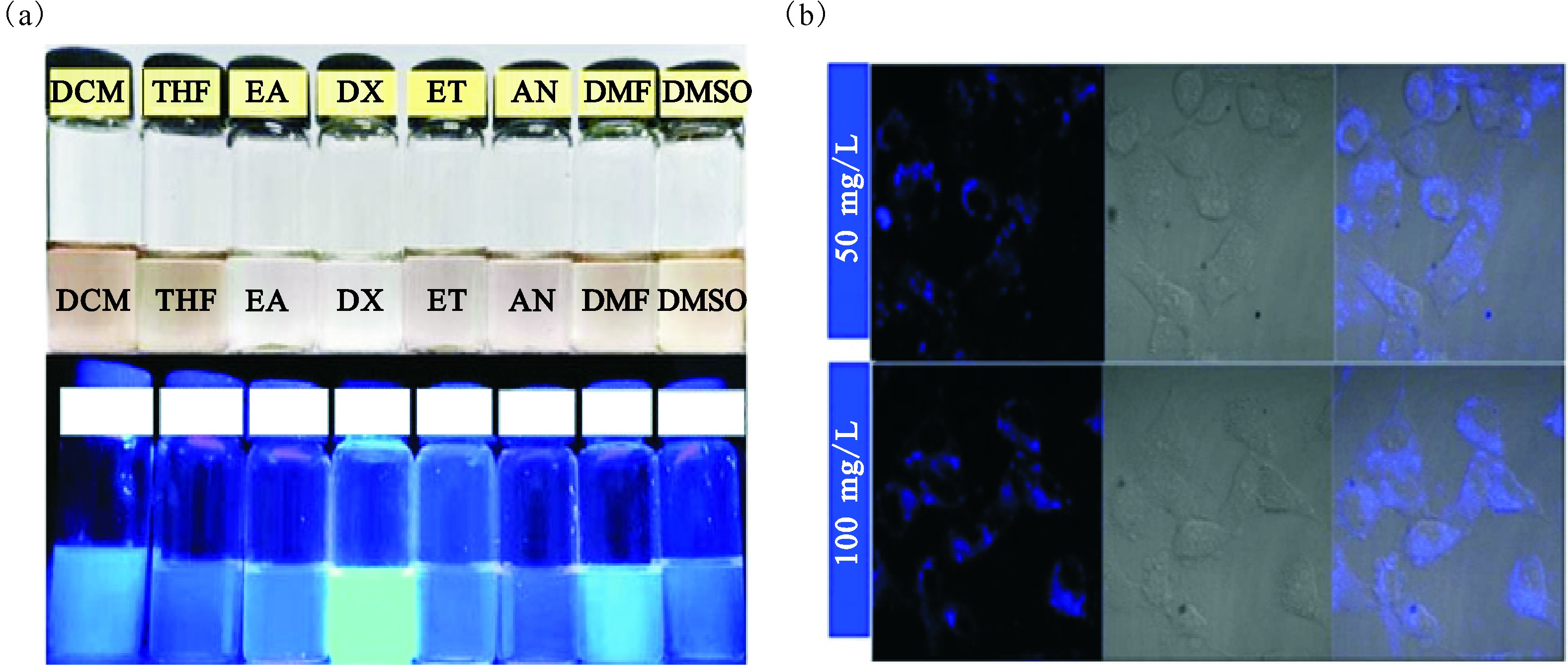
以及细胞与不同浓度石墨炔共同培养12 h后的共焦荧光显微镜图像(发射波长为405 nm)(b)[34]
DCM:二氯甲烷;THF:四氢呋喃;EA:乙酸乙酯;DX:二氧六环;ET:乙醇;AN:乙腈;DMF:N,N-2甲基甲酰胺;DMSO:二甲基亚砜
2.5 、吸附领域
由于石墨炔结构对有机物具有很好的结合效果,石墨炔也被应用于环境有机污染物的处理。Li等[35]在三聚氰胺海绵上合成石墨炔(图5),该海绵材料对有机油污具有出色的吸附能力(最高达其自重的160倍)、可靠的稳定性(即使将其浸入强酸和强碱中7 d,仍然具有出色的吸污能力)以及出色的循环使用性能(重复次数高达100次)。这些特征表明,该吸附材料可用于清理许多有机污染物。Liu等[36]通过将合成好的石墨炔泡沫铜材料制成膜的方法得到了石墨炔分离膜,通过实验证明了其可以有效地去除水体系中的Pb2+,达到净化污水的目的。Shi等[37]基于第一性原理计算,进行了非贵金属(Fe、Co、Ni和Cu)和贵金属(Ru、Rh、Pt和Pd)单原子在石墨炔上的吸附和扩散行为,发现石墨炔的特殊孔结构是最稳定的吸附位点。此外,该工作还研究了单金属原子的扩散特性和生长方式。随着最稳定部位的吸附越来越强,扩散将变得更加困难。该研究结果还得出Fe、Co、Cu、Ru、Rh、Pt和Pd等吸附原子呈现出生长3D簇的趋势,而Ni吸附原子呈现出在高浓度下生长2D金属板的趋势。
3 、石墨炔在放射化学领域中的应用
3.1、 石墨炔对关键离子的吸附研究
本课题组[38]针对石墨炔在放射化学离子吸附领域中的应用进行了实验和理论计算研究(图6(a))。研究表明,石墨炔对Th4+和Cs+具有明显的吸附效果,而对La3+、Eu3+、Tm3+、UO2+2和Sr2+未呈现吸附现象(图7)。从图7中可以看到,在混合溶液中石墨炔铜箔复合材料对Th+/UO2+2和Cs+/Sr2+这两组离子对的混合溶液具有很好的吸附分离效果,而铜箔本身则表现为共同吸附。这一方面说明石墨炔材料的优异吸附性能,另一方面也表明了石墨炔铜箔复合材料中石墨炔的吸附占主导作用。石墨炔材料吸附Th4+和Cs+的吸附等温线示于图8。如图8所示,Th4+和Cs+的吸附均符合Langmuir吸附模型,最大吸附量分别为(33.5±4.2) mg/g和(12.7±1.1) mg/g。本课题组[38]进而通过理论计算详细研究了UO2+2、Th4+、Pu4+、Am3+、Cm3+、La3+、Eu3+、Tm3+、Cs+、Sr2+分别与石墨炔的相互作用(图9)。计算表明,在扣除水化能后,Th4+、Pu4+、Am3+、Cm3+与Cs+可以在水溶液中与石墨炔结合,但UO2+2、La3+、Eu3+、Tm3+等离子则无法进行吸附。Th4+、Pu4+、Am3+、Cm3+扣除水化能之后的吸附能分别为-361、-651、-688、-634 kJ/mol。
图5 石墨炔-三聚氰胺海绵吸附材料[35]
![图5 石墨炔-三聚氰胺海绵吸附材料[35]](/uploads/allimg/210323/1349214605-5.jpg)
Fig.5 GDY-melamine sponge adsorbing materials[35]
HEB:六乙炔基苯;THF:四氢呋喃;TMEDA:四甲基乙二胺
图6 石墨炔对不同离子选择性吸附示意图(a)及石墨炔膜选择性分离离子示意图(b)[38]
![图6 石墨炔对不同离子选择性吸附示意图(a)及石墨炔膜选择性分离离子示意图(b)[38]](/uploads/allimg/210323/1349211M6-6.jpg)
Fig.6 Schemes of selective adsorption of GDY on different ions(a) and GDY membrane selectively separating different ions(b)[38]
3.2 、锕系离子与石墨炔相互作用
计算结果表明[38],锕系离子是在有配位硝酸根的条件下吸附在石墨炔三角孔洞上。石墨炔吸附不同锕系离子之后,其结构呈现出不同的变形特点。石墨炔与Th4+、Pu4+、Am3+、Cm3+之间存在着强烈的键合作用。计算表明,三价锕系离子Am3+、Cm3+与石墨炔三角形空穴的三条边均有成键作用,而四价Th4+、Pu4+只与石墨炔三角形空穴的两条边具有成键作用。吸附了Am3+、Cm3+后的石墨炔三条边均具有较大的角度弯曲变形。吸附Pu4+的石墨炔无论三条边是否与Pu4+直接键合均具有明显的变形。但是吸附Th4+的石墨炔只有与Th4+直接成键的两条边具有明显的变形,而另一条边基本不发生变形。这是因为Th4+、Pu4+、Am3+、Cm3+分别具有0、4、6、7个5f电子,5f电子可反馈至石墨炔的共轭体系中,使得石墨炔的变形更加明显。Pu4+的4个5f电子可以通过反馈间接地影响石墨炔的第三条边。5f电子的反馈作用增加了石墨炔与锕系离子之间的相互作用。与三价镧系离子的4f电子相比,5f电子空间上具有更好的延展性,更倾向于成键,这也是石墨炔能分离吸附锕系离子和镧系离子的原因之一。对比简单的锕系离子Th4+、Pu4+、Am3+、Cm3+,UO2+2因为具有酰基氧,位阻较大难以与石墨炔稳定成键,难以形成稳定的结构。对于Cs+而言,由于其被石墨炔吸附后石墨炔的结构变形不明显,同时结构变形比较均匀,不能体现类似Th4+、Pu4+、Am3+、Cm3+被石墨炔吸附后形成共价键的饱和性和方向性,因此其吸附主要由静电相互作用导致。通过拉曼光谱(图10[38]),发现了石墨炔上的炔键的特征峰蓝移。通常而言,炔键的蓝移意味着炔键的弯折。实验结果与理论计算结果一致,均表明石墨炔在与锕系离子结合后会发生明显的形变。值得注意的是结合锕系离子后石墨炔产生的形变与结合过渡金属原子后的形变规律存在明显差别。
图7 石墨炔吸附选择性检测(a)以及石墨炔与基底铜箔对Cs+/Sr2+(b)和Th4+/UO2+2吸附选择性对比(c)[38]
![图7 石墨炔吸附选择性检测(a)以及石墨炔与基底铜箔对Cs+/Sr2+(b)和Th4+/UO2+2吸附选择性对比(c)[38]](/uploads/allimg/210323/1349211421-7.jpg)
Fig.7 Adsorption of GDY on various metal ions(a), selective adsorption of both Cu foil itself and GDY on Cs+/Sr2+(b), selective adsorption of both Cu foil itself and GDY on Th4+/UO2+2(c)[38]
图8 石墨炔吸附Th4+(a)、Cs+(b)的吸附等温线[38]
![图8 石墨炔吸附Th4+(a)、Cs+(b)的吸附等温线[38]](/uploads/allimg/210323/1349211Y1-8.jpg)
Fig.8 Adsorption isotherm of GDY to Th4+(a) and Cs+(b)[38]
1——最小二乘法拟合曲线,2——Langmuir模型拟合曲线,3——Freundlich模型拟合曲线
图9 石墨炔(a)、吸附Th4+之后变形的石墨炔(b)
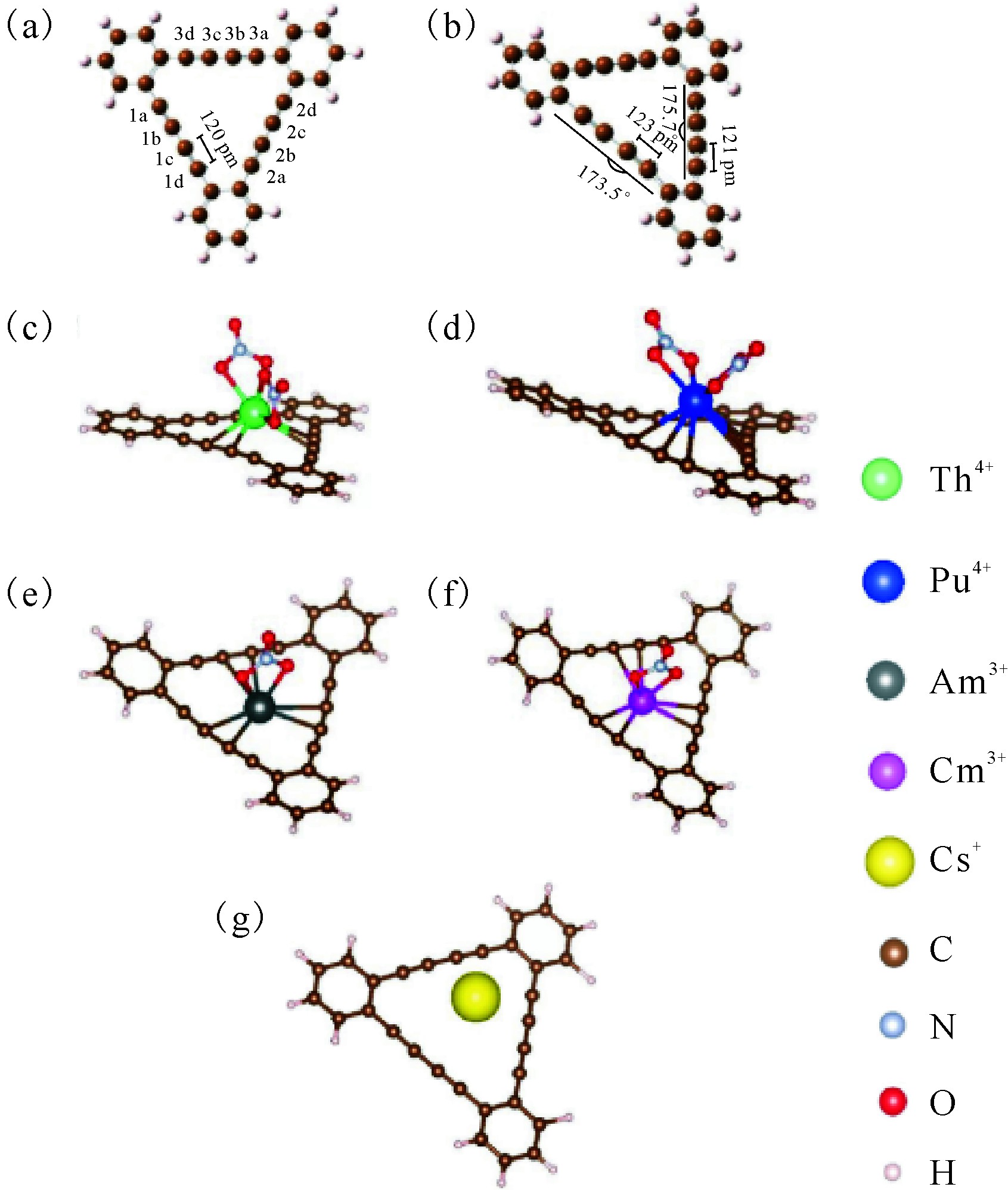
以及石墨炔与Th4+(c)、Pu4+(d)、Am3+(e)、
Cm3+(f)和Cs+(g)相互作用计算结构图[38]
同时X射线光电子能谱(X-ray photoelectron spectroscopy, XPS)结果(图11)表明石墨炔对Th4+的吸附为化学键合作用[38]。从XPS谱图上,可发现Th4+的4f轨道存在峰裂分现象。通过对Th(NO3)4·3H2O以及四个Th(NO3)4·3H2O构成的团簇的分别计算,发现团簇态的Th(NO3)4·3H2O的4f7/2轨道的能量计算值为333.7 eV,单体态的Th(NO3)4·3H2O的4f7/2轨道能量的计算值为333.4 eV,这两个峰分别对应XPS谱图的334.8 eV和334.3 eV两个峰。因此推测,Th4+的4f轨道细微的分峰源自于Th4+的聚集态和单离子态微小的差异。同时研究表明,吸附在石墨炔上的锕系金属离子之间的距离超过了化学作用的距离,结合石墨炔自身三角孔洞中心间距大于化学作用范围、以及XPS的峰裂分现象,进一步证实了Th4+吸附在石墨炔上应以单离子态存在。
图10 石墨炔吸附Th4+前后Raman光谱变化[38]
![图10 石墨炔吸附Th4+前后Raman光谱变化[38]](/uploads/allimg/210323/1349214O3-10.jpg)
Fig.10 Raman spectra after/before adsorption of Th4+ by GDY[38]
(a)——石墨炔吸附Th4+后的原始吸收曲线和拟合曲线, 2 145.0 cm-1和2 170.0 cm-1是石墨炔的炔键特征峰, 2 198.9 cm-1是石墨炔吸附Th4+后的新特征峰; (b)——石墨炔吸附Th4+前的吸收曲线
图11 石墨炔吸附Th4+后XPS峰发生裂分[38]
![图11 石墨炔吸附Th4+后XPS峰发生裂分[38]](/uploads/allimg/210323/1349212453-11.jpg)
Fig.11 XPS splitting of Th4+ adsorbed on GDY[38]
344.1 eV 和334.8 eV分别代表聚集态Th4+的4f5/2 和4f7/2峰, 343.3 eV 和334.3 eV则分别代表被GDY吸附后Th4+的相应峰
3.3 、石墨炔在放化分离中的应用
研究结果表明,石墨炔对三价锕系离子、Th4+和Cs+有着明显的选择性吸附能力,说明石墨炔有望在核燃料循环过程中实现An3+/Ln3+、Th4+/UO2+2、Cs+/Sr2+等离子对之间的高效分离[38]。如前所述,石墨炔膜已经被证明具有很好的离子分离效果[37],结合现有的石墨炔的优异力学性质和制备技术可以合成石墨炔分离膜实现核燃料循环工艺中高效的离子选择性分离(图6(b))。石墨烯在放射化学中的应用受到广泛关注,氧化石墨烯对放射性元素具有强的吸附能力,修饰后的氧化石墨烯可以针对特定的放射性离子进行吸附[39]。对于石墨炔而言,不经修饰就具有很强的吸附能力与选择性。石墨炔吸附离子后呈现单粒子态,可以进一步对锕系元素进行研究。同时,石墨炔不经修饰就可以实现An3+/Ln3+、Th4+/UO2+2、Cs+/Sr2+等离子对的分离。
4、 总结与展望
现有研究已经表明石墨炔在放化分离领域有着重要的应用前景。上述研究处于刚刚起步阶段,需要进一步深入研究。为此,提出以下几点展望:
(1) 由于石墨炔具有优异的力学性质和选择性吸附性能,石墨炔分离膜的合成及其在镧锕分离、钍铀分离和锶铯分离的应用是研究的重点之一;还需要进一步研究石墨炔的辐照稳定性和其在较高酸度环境中的选择性分离性能;
(2) 单离子磁体的磁各向异性往往优于其聚集状态,锕系元素的5f轨道的径向延伸比镧系元素的4f轨道更大,这使得其与配体轨道有更大的重叠,从而使得晶体场分裂明显;U(Ⅴ)的晶体场分裂能甚至比镧系元素高一个数量级[40],这就让锕系单离子磁体的性能研究显得十分重要;单离子催化剂与聚集状态的催化剂相比具有更高的催化性能,锕系离子具有对末端炔基加成反应的催化能力[41],如果合成锕系单离子催化剂将有利于进一步提高催化性能;本课题组的研究已经表明结合在石墨炔上的锕系离子以单离子态存在;这一研究结果为锕系单离子磁体和催化剂的合成提供了新的思路;
(3) 石墨炔与锕系离子结合后自身产生的形变为5f电子与大π键体系的相互作用提供了新的研究思路,为研究锕系元素的5f电子特性提供了新的方向;同时有助于对石墨炔自身结构特征和相关性质的深入认识;
(4) 石墨炔具有大的共轭体系,而且石墨炔可以通过修饰形成功能材料;修饰石墨炔在吸附锕系单离子之后有望形成单离子电子学器件。
下一篇:没有了


 专科论文咨询
专科论文咨询
