生物制药行业中连续生物加工的应用综述-985毕业论文网
摘 要: 近年来, 连续生物加工备受各界关注, 在生物制药等领域中的应用越来越广泛。阐明连续生物加工技术在生物制药领域中的发展历程、进展及其在单克隆抗体等产品生产中的应用, 对于生物制药发展具有重要的指导意义和参考价值。分析连续生物加工相对于传统批次处理的优势和存在的问题, 以及未来在制药行业的机遇与面临的挑战, 可以为连续生物加工的研究和产业发展提供参考。克服连续生物加工技术的不足并充分发挥其优势, 对于生物制药等领域的发展具有重要意义。随着现代生物工业对灵活性和均一性等的持续追求, 连续生物加工必将在生物制药等生物技术领域发挥更大的作用。
关键词: 连续生物加工; 生物制药; 发展; 应用; 机遇与挑战;
Abstract: Recently, continuous bioprocessing gains increasing attention due to its wide application in biopharmaceutical and other fields.It is important to analyze the developments and progresses of continuous bioprocessing and its applications in the production of biopharmaceuticals, such as monoclonal antibodies, for the development of biotechnology industries.It is also important to better understand the advantages of continuous bioprocessing compared with the traditional batch processing and to overcome the existing problems and challenges in the biopharmaceutical industry.With the pursuit of flexibility and standardization, continuous bioprocessing will play a critical role in biopharmaceutical and biological industries.
Keyword: continuous bioprocessing; biopharmaceutical; development; application; prospect and challenges;
目前生物产品的商业化生产大多为分批加工过程, 分批加工可实现产品关键质量的离线检测。但分批加工存在着设备占地面积大、前期投入成本高、操作繁琐和成品质量不稳定等不足。随着生物制药行业的发展, 对生物合成技术的要求也越来越高。以往传统的批次生物加工方法已经不能满足当今社会对于高产量、低污染的要求, 批次加工向连续生物加工转变已成为工业生产的发展趋势[1]。连续生物加工概念于30多年前提出, 是指利用连续的物料流动通过各种单元操作达到一个稳定状态, 同时生产质量均一产品的过程[2]。由于潜在优势众多, 连续生物加工在生物制药行业的应用日益广泛[3]。
1 连续生物加工的研究进展及应用现状
1.1 连续生物加工的研究进展
过去的10多年里, 治疗用蛋白药物尤其是抗体相关产品的市场已经发生了显着的变化, 生物医药市场增长率每年超过10%[4,5,6]。对药效要求的提高以及个性化用药趋势的发展都导致药物的产量降低[7]。重磅新药品种研发难度的增加以及生物仿制药发展带来的竞争增大了生产商的成本压力[6,7,8,9,10]。此外, 制药公司为向新兴市场提供患者可负担得起的药物进一步增强了对高效生产过程的需求[11]。
据市场调研公司Evaluate Pharma预测, 2018年全球处方药销售额将达到8 850亿美元, 全球药品研发支出预计达到1 490亿美元。未来生物制药行业充满机遇, 因此对生产过程也就有了更高的要求[12]。为保持或加强市场地位, 生物制药工业将依靠低成本和灵活的生产设施以适应市场发展。与批次加工系统相比, 利用连续生物加工的系统具有降低制造成本、简化制造设备规模、改善产品质量以及再生和标准化终产品等明显的优势[13]。其中最大的优势是增加了设备灵活性和降低了成本。生产规模上的灵活性是指可生产包含大批量和小批量药物在内的广泛产品组合[14]。Walther等[15]指出:相对于传统的批次加工, 连续生物制造过程可以降低55%的成本, 例如利用连续生物加工技术生产非单克隆抗体产品, 运营成本可从批次处理的每克1 230美元降到每克250美元。Hammerschmidt等[16]指出:使用标准的批次过程生产单克隆抗体, 色谱纯化一、二期的总成本为5 500万美元, 而使用基于连续沉淀纯化的连续过程时, 色谱纯化一、二期的总成本花费仅为1 600万美元, 成本降低了70%以上。连续生产的大部分成本优势来自于更少的生产设备和占地面积的投入。较小的生产规模有利于提高容量利用率、减少产品转换、简化生产放大过程[17]。表1总结了批次生物加工与连续生物加工的优缺点。
表1 批次生物加工与连续生物加工的比较Table 1 Comparison of batch bioprocessing and continuous bioprocessing

连续生物加工目前还处于探索阶段, 从批次加工到准连续加工再到连续加工是一个渐进、探索的过程。在未来, 为了降低成本和提高生产力, 小规模的综合连续加工步骤可以作为当前批次加工的一种替代方案。而对于一些中小企业而言, 将原传统批次加工生产完全转换为连续生物加工, 需要开发全新的上游加工流程和下游单元操作设备, 投入较大[14]。因此, 采用半连续生物加工是探索连续生物加工阶段的一个较好选择。Pollock[21]提出了一种综合实验方法和模型, 用于评估半连续色谱法获取单克隆抗体在临床和商业生产领域的应用潜力, 过渡方法可以是连续的上游处理结合传统的批次下游处理, 也可以是完整的连续下游处理与批次的上游处理整合。早在1995年, Yamane等[22]就将半连续的部分流程整合到批次加工系统中, 用于种子的培养和生产。采用连续上游加工是为了消除潜在的可以限制细胞生长和生存能力的有毒代谢产物, 维护恒定的营养水平, 不仅可以减小对敏感细胞压力, 且除去发酵液中不稳定的蛋白质可以消除种子退化的风险。
1.2 连续生物加工的应用现状
上游连续加工已在单克隆抗体等生物制品的生产中推广应用。Rodriguez等[23]利用上游连续加工生产干扰素, 采用的连续灌注法在改善了产品质量的同时也缩短了培养时间, 降低了抑制浓度, 由此提高了生产力。Luttmann等[14]将一个完整的连续下游加工整合到原有的批次循环上游过程, 组成半连续生物加工过程, 以毕赤酵母作为宿主系统生产疟疾疫苗, 取得较好的成效。辉瑞公司利用连续和半连续培养工艺生产抗血友病药物重组抗血友病因子ReFacto AF和重组人凝血因子IX, 结果表明连续加工过程不但增加了设备的操作灵活性, 还确保了细胞系的遗传稳定性[24]。
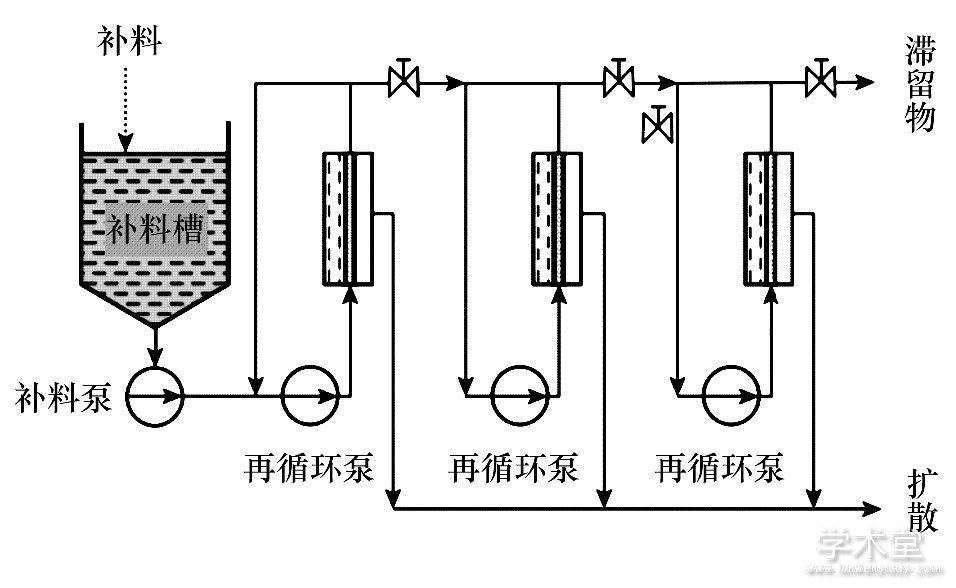
利用连续生物加工生产单克隆抗体、非单克隆抗体、治疗蛋白、重组细胞、干细胞、凝血因子以及疟疾疫苗等药物方面的尝试, 对未来连续生物加工的技术成熟和全面商业运用提供了经验。Castilho[25]通过灌注细胞培养生产重组治疗蛋白的过程探索了连续生物加工的整合过程。Jungbauer[26]介绍了生物制药的下游加工过程中的相关装置, 为实现工业化应用提供指导和借鉴, 图1~3为生物制药连续下游加工的流程及其相关设备。图1显示细胞分解后经连续的重折叠, 纯化修正获得重组蛋白质的生产流程。图2, 3是重组蛋白连续的下游离心设备及过滤设备, 通过连续的离心和过滤处理, 能进一步提高重组蛋白生产的效率及灵活性。图2中箭头表示溶液的流向, 弯曲的箭头和虚线分别表示自旋方向和自旋轴。
图1 重组蛋白质生产下游加工的总流程Fig.1 General process of downstream processing for re-combinant protein
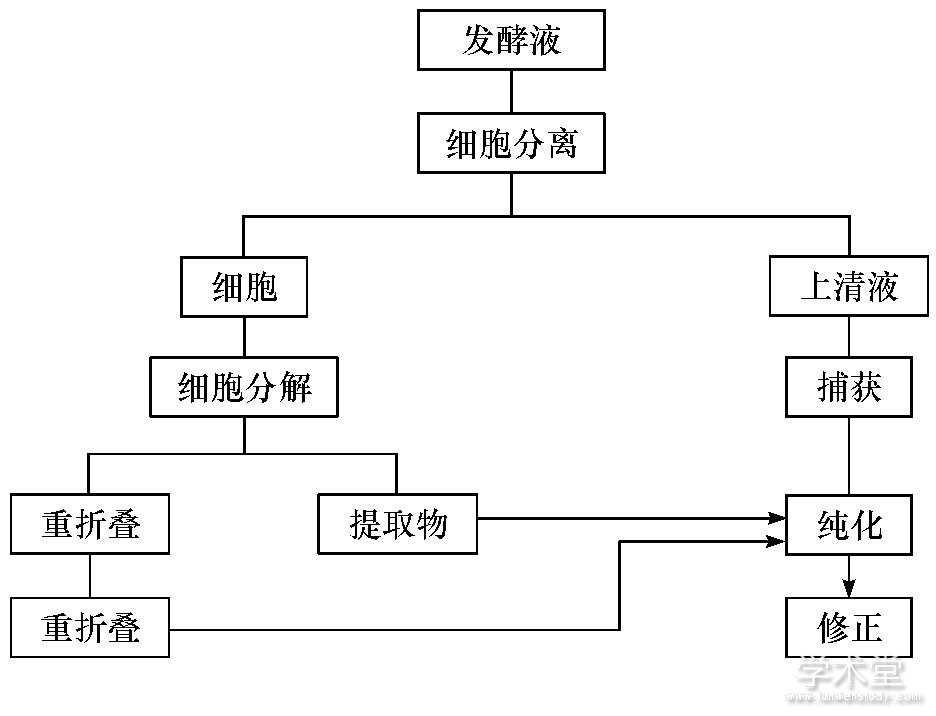
图2 用于重组蛋白生产下游加工的典型离心设备Fig.2 Typical centrifuge configurations used in down-stream processing of recombinant protein
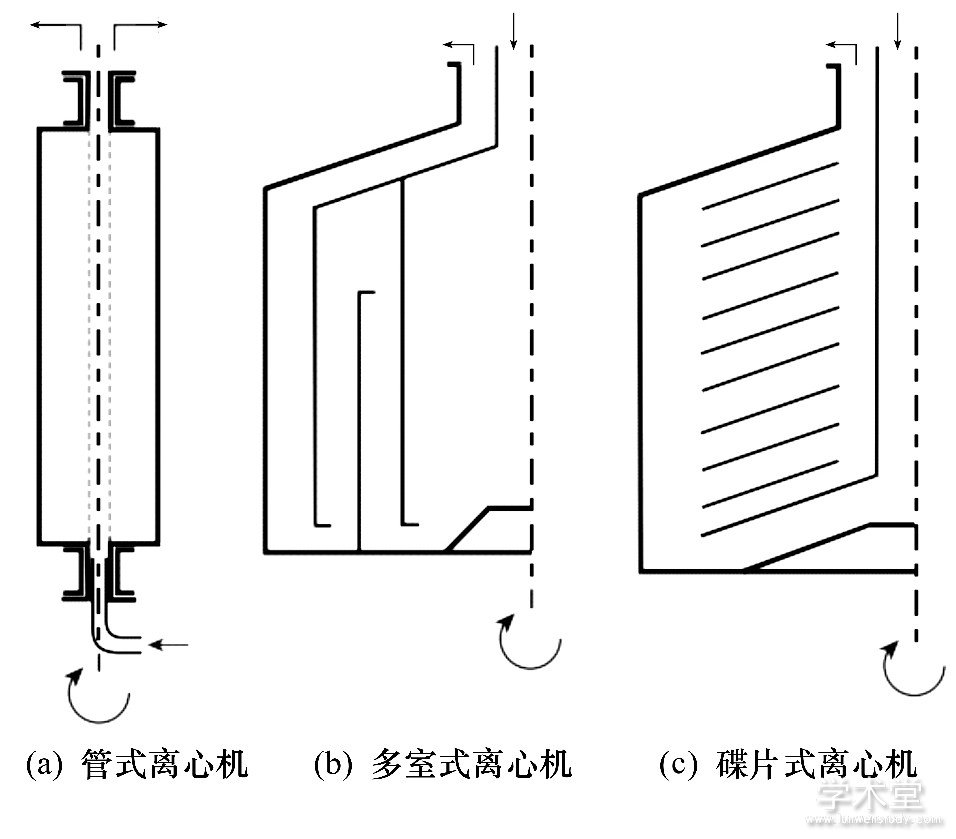
图3 连续过滤单元操作及其相关设备Fig.3 Continuous filtering unit operation and related equipment
Zydney[27]综述了适合连续下游生物加工的最新分离技术, 着重介绍了最适合单克隆抗体等分泌蛋白生产的单元操作, 对高价值生物制品的连续下游加工作了回顾。Rathore[28]综述了2005—2015年间连续生物加工的主要进展, 介绍了上游和下游连续生物加工的各种设备, 对其应用和优缺点进行了讨论, 结果见表2。
表2 连续生物处理上下游处理设备及其优缺点Table 2 Advantages and disadvantages of equipment in con-tinuous upstream and downstream processing

Walther等[15]探索了用连续生物处理进行重组蛋白生产的经济性, 并对连续生产单克隆抗体 (mAb) 和非单克隆抗体 (non-mAb) 进行了定量和定性的比较, 结果见表3, 4。
表3 生物工艺及相关设备说明Table 3 Description of biological processes and related equipment
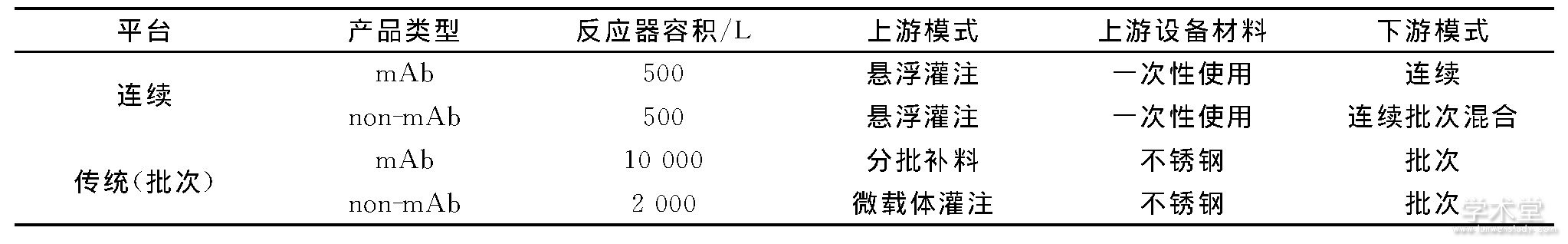
表4 对批次和连续平台的高水平过程假设Table 4 High-level process assumptions for both conventional and continuous platforms
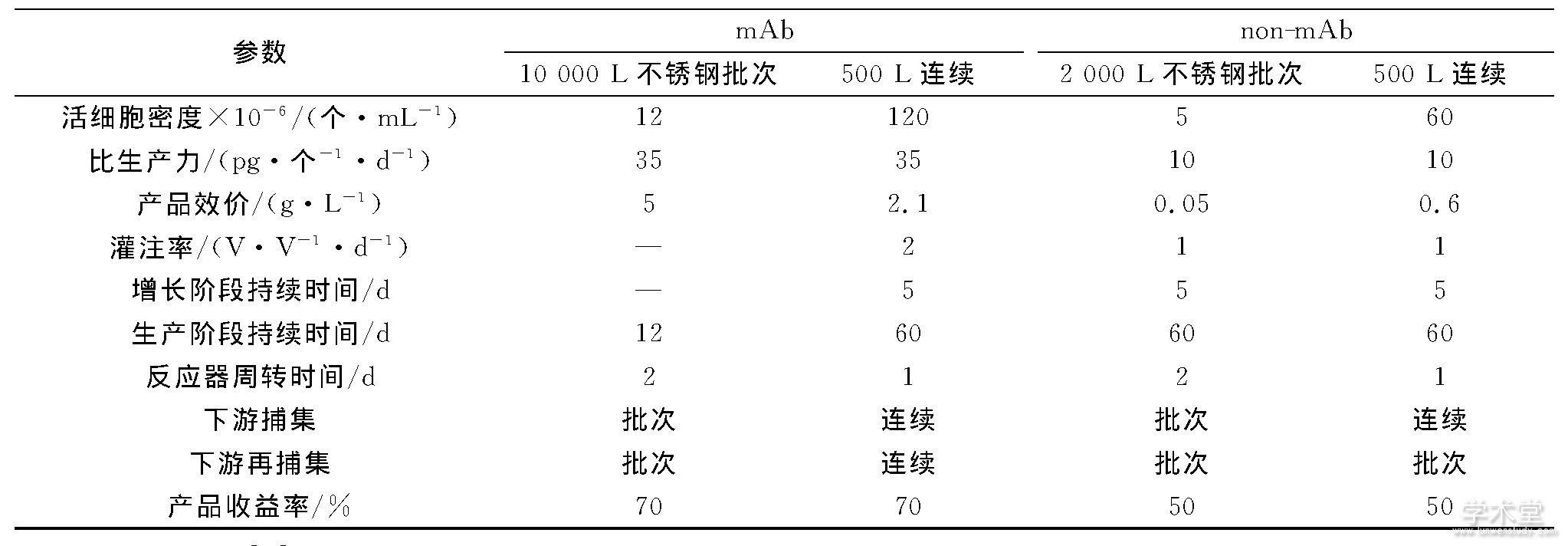
Godawat等[29,29]构建了一个完整的端对端 (endto-end, 端对端) 连续生物加工系统, 该系统是一个耦联两个周期性逆流色谱系统的连续灌注生物反应器, 并用于单克隆抗体生产。图4是连续上游加工结合传统批次下游加工的组合生产方式, 相对于整个过程的批次加工, 连续上游加工过程消除了潜在的有毒代谢产物, 一定程度上提高了设备的灵活性;图5是完全连续生物加工过程, 相对于图4的生产方式, 这种连续加工系统精干、灵活, 可控性强, 简化了操作步骤, 节省了成本, 更适于过程优化和控制。
图4 连续上游加工和捕获组合批次下游加工Fig.4 Continuous upstream+capture, batch downstream
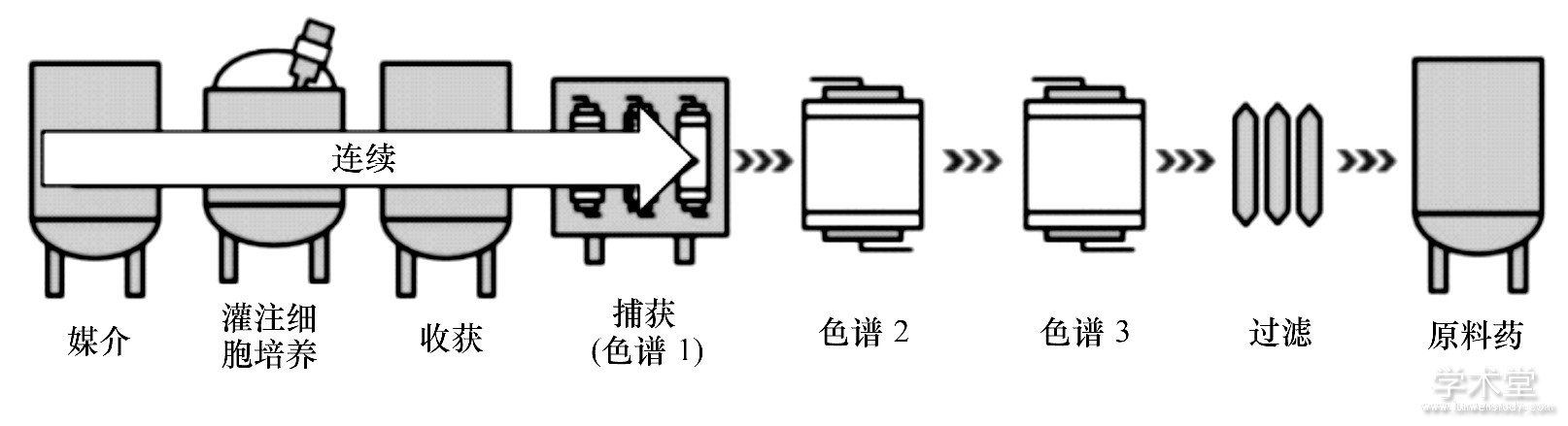
图5 端对端连续上游加工组合连续下游加工Fig.5 End-to-end continuous upstream and downstream
连续灌注技术在工业生产重组凝血因子上的成功应用已有20多年历史[24]。Xenopoulos等[30]描述了一个连续的下游纯化过程并对相关产品成本进行了分析, 相对于传统下游纯化过程, 新型的下游纯化过程在连续加工模式时, 商业运营和临床操作相比批次加工模式能节省更多成本。Dutta等[31]成功利用连续逆流切向色谱方法从澄清细胞培养浓缩液中提取两种不同的单克隆抗体。Girard等[32]利用序贯多柱色谱法优化了单克隆抗体的纯化工艺。Hardick等[33]开发了利用纳米纤维吸附剂连续纯化单克隆抗体的技术。Cunha等[34]使用连续灌注培养结合连续浓缩和透析过滤来高效浓缩和收集人骨髓间质干细胞, 是连续生物加工概念在细胞治疗方面的成功应用之一。Klutz等[35]阐述了连续生物处理设计中涉及的概念并建立了上游和下游过程的半工业规模设施, 以期用于商业生产。Miotto等[36]开发了连续的生物加工方法生产基质细胞, 这是目前最为前沿的技术, 也再一次扩大了连续生物加工的应用范围。Patil等[37]总结了药用蛋白生产连续加工上下游技术, 介绍了连续细胞培养和连续色谱技术等一系列连续生物加工相关的连续操作。这些连续操作保证了连续生物加工更好地发挥优势, 为生物制剂及药物生产服务。
生物连续加工目前还没有覆盖所有药物生产领域, 但已经被不断地应用于实际生产。目前生物连续加工已成功应用于生物医药的生产[38], 由于其突出的优势和广阔的前景, 除在生物制药、生物合成等领域继续发挥重要作用外, 还将在更多相关领域得到广泛应用。
2 连续生物加工的机遇及挑战
目前有两个主要驱动因素推动人们对连续生物加工的关注。首先在经济上, 生物制药商面临着降低生物治疗药物价格方面的压力, 特别是要增加对发展中国家救命药物的供应;其次是来自低成本制造商日益激烈的竞争, 他们中很多着重于对专利保护到期生物药物的仿制[39]。据统计, 2012—2018年专利到期仿制药进入市场带来的风险损失超过2 900亿美元。由于很多新药专利相继到期, 近年来, 各大制药企业应对生物仿制药的压力也越来越大[12]。
一些研究表明:生物仿制药也可以受益于连续生物加工。生物仿制药开发的目的是使产品达到原研药品质的关键质量属性要求。在一个传统的批次生物加工过程中, 来自于不同培养阶段的蛋白亚型混合物需要被分离或者混合, 从而获得合适的目标药物, 这可以通过维持恒定、稳定培养条件的连续灌注加工来实现。在反应过程的开始或者结束时会有副产品生成, 但是可以通过连续的灌注流过程将其去除。Dorvignit等[40]利用连续灌注过程培养重组鼠骨髓瘤细胞生产利妥昔单抗生物仿制药, 产物生物学特性优于原研产品。不过, 大众对于寻找能降低新药研发、临床试验以及生产等各方面成本的生产方式还是越来越感兴趣。FDA因为连续生物加工能够减少对生产流程的人工干预并且改善过程控制而对其大力支持。
尽管连续生物加工有很多优势, 目前其推广应用仍有一些限制。许多相关的教科书已经回答了为什么在目前的大环境下许多工厂企业仍然大量使用批次生产而不是连续生物加工的问题。目前连续生物加工主要存在以下不足[41]:连续反应器的均质性差, 包括营养物质的不足或局部细胞积累;实现长期无菌连续操作存在困难;连续生物加工设备长时间的运行导致在短期加工多种产品时设备灵活性不足;在实验室中, 用复杂的连续培养系统进行过程开发试验所需成本高、耗时长;细胞存在遗传不稳定性。
连续操作为实时过程监控和自动化控制领域带来了机遇, 特别是色谱操作的连续处理在缩减反应器尺寸和降低成本的同时, 能更有效地利用昂贵的色谱填充介质。传统的分批补料方法需要关闭过程控制来使中间产物释放到下一步流程, 而这一过程不适用于连续生物加工。连续生物加工所需的是能即时传输数据并可用于自动或半自动过程控制的快速、理想的在线过程分析技术, 所以如何实现连续生物加工的精确控制目前是一个需要重点研究的课题。连续生产过程控制除了实时监控pH、温度和溶解氧等标准参数之外, 若能获取细胞浓度和活力、主要营养物质以及代谢副产物的实时信息将会使其更实用。为此, Mercier等[42]利用介电光谱法、近红外光谱法对连续灌注细胞培养过程进行分析检测, 实现了连续生物加工的过程控制。
3 结论
最近, 越来越多的生物制药公司致力于在生产过程中建立连续的加工过程。行业竞争和政府监管带来的压力推动了该行业对连续生物加工技术的创新和实施。目前, 实现一个综合连续生物加工平台所必需的模块大部分已经建立。然而, 在连续生物加工成功商业应用之前, 还有技术瓶颈需要攻克。这些挑战包括更好的在线过程分析技术、细胞系稳定性、实现长期无菌操作所需设备的可靠性、缩小模型的可靠性、强大的自动化以及对所有单元操作的全局过程控制。这些技术挑战可以通过行业、学术界和监管机构之间的共同努力合作解决。尽管从批次加工转变到连续加工过程可能并不简单, 但是连续加工所带来的长远利益可以证明其对生物制药产业的发展至关重要。
参考文献:
[1] BERTRAMS K, COUPAIN N, HOMBURG E.Solvay:history of a multinational family firm[M].Cambridge:Cambridge University Press, 2013.
[2] ARATHOON W R.Large-scale cell culture in biotechnology[J].Science, 1986, 232 (4756) :1390-1395.
[3] HANSON J.Control of a system of loss-in-weight feeders for drug product continuous manufacturing[J].Powder technology, 2018, 331:236-243.
[4] AGGARWAL S.What’s fueling the biotech engine-2010to2011[J].Nature biotechnology, 2011, 29 (12) :1083-1089.
[5] BUTLER M, MENESES-ACOSTA A.Recent advances in technology supporting biopharmaceutical production from mammalian cells[J].Applied microbiology and biotechnology, 2012, 96 (4) :885-894.
[6] LEVINE H L, LILJIA J E, STOCK R, et al.Efficient, flexible facilities for the 21st century[J].BioProcess international, 2012, 10 (11) :20-30.
[7] ANICETTI V.Biopharmaceutical processes:aglance into the21st century[J].Bioprocess international, 2009, 7:4-11.
[8] WARIKOO V, GODAWAT R, BROWER K, et al.Integrated continuous production of recombinant therapeutic proteins[J].Biotechnology and bioengineering, 2012, 109 (12) :3018-3029.
[9] GOTTSCHALK U, BRORSON K, SHUKLA A A.The need for innovation in biomanufacturing[J].Nature biotechnology, 2012, 30 (6) :489-492.
[10] JAGSEHIES G.Where is biopharmaceutical manufacturing heading?[J].Biopharm international, 2008, 21 (10) :72-88.
[11] WALSH G.Biopharmaceutical benchmarks 2010[J].Nature biotechnology, 2014, 32 (10) :992-1000.
[12] STRICKLAND I.World Preview 2018:embracing the patent cliff[J].Evaluate pharma, 2012, 1-39.
[13] LANGER E S.Continuous bioprocessing in operation:When will technologies be fully realized?[J].Genetic engineering&biotechnology news, 2015, 35 (21) :32-32.
[14] LUTTMANN R, BORCHERT S O, MUELLER C, et al.Sequential/parallel production of potential malaria vaccines-a direct way from single batch to quasi-continuous integrated production[J].Journal of biotechnology, 2015, 213:83-96.
[15] WALTHER J, GODAWAT R.The business impact of an integrated continuous biomanufacturing platform for recombinant protein production[J].Journal of biotechnology, 2015, 213:3-12.
[16] HAMMERSCHMIDT N, TSCHELIESSNIG A, SOMMER R, et al.Economics of recombinant antibody production processes at various scales:industry-standard compared to continuous precipitation[J].Biotechnology journal, 2014, 9 (6) :766-775.
[17] SCHMIDT S R.Drivers, opportunities, and limits of continuous processing[J].Bioprocess international, 2017, 15 (3) :30-37.
[18] SHARUDDIN S D A, ABNISA F, WAN M A W D, et al.A review on pyrolysis of plastic wastes[J].Energy conversion&management, 2016, 115:308-326.
[29] QURESHI K M, LUP A N K, KHAN S, et al.A technical review on semi-continuous and continuous pyrolysis process of biomass to bio-oil[J].Journal of analytical&applied pyrolysis, 2018, 131:52-75.
[20] STEINEBACH F, MULLER T, MORBIDELLI M.Continuous counter-current chromatography for capture and polishing steps in biopharmaceutical production[J].Biotechnology journal, 2016, 11 (9) :1-16.
[21] POLLOCK J, BOLTON G, COFFMAN J, et al.Optimising the design and operation of semi-continuous affinity chromatography for clinical and commercial manufacture[J].Journal of chromatography, 2013, 1284:17-27.
[22] YAMANE T.Bioreactor operation modes[M]//ASENJO J A.Bioreactor System Design.New York:Marcel Dekker Inc, 1994:348.
[23] RODRIGUEZ J, SPEARMAN M, THARMALINGAM T, et al.High productivity of human recombinant beta-interferon from a low-temperature perfusion culture[J].Journal of biotechnology, 2010, 150 (4) :509-518
[24] DESAI S G.Continuous and semi-continuous cell culture for production of blood clotting factors[J].Journal of biotechnology, 2015, 213:20-27.
[25] CASTILHO L R.Continuous animal cell perfusion processes:the first step toward integrated continuous biomanufacturing[M]//SUBRAMANIAN G.Continuous Processing in Pharmaceutical Manufacturing.Weinheim:Wiley-VCH Verlag GmbH&Co.KGaA, 2014
[26] JUNGBAUER A.Continuous downstream processing of biopharmaceuticals[J].Trends in biotechnology, 2013, 31 (8) :479-492.
[27] ZYDNEY A L.Continuous downstream processing for high value biological products:a review[J].Biotechnology and bioengineering, 2016, 113 (3) :465-475.
[28] RATHORE A S, AGARWAL H, SHARMA A K, et al.Continuous processing for production of biopharmaceuticals[J].Preparative biochemistry and biotechnology, 2015, 45 (8) :836-849.
[29] GODAWAT R, KONSTANTINOV K, ROHANI M, et al.End-to-end integrated fully continuous production of recombinant monoclonal antibodies[J].Journal of biotechnology, 2015 (213) :13-19.
[30] XENOPOULOS A.A new, integrated, continuous purification process template for monoclonal antibodies:process modeling and cost of goods studies[J].Journal of biotechnology, 2015, 213:42-53.
[31] DUTTA A K, TRAN T, NAPADENSKY B, et al.Purification of monoclonal antibodies from clarified cell culture fluid using protein A capture continuous countercurrent tangential chromatography[J].Journal of biotechnology, 2015, 213:54-64.
[32] GIRARD V, HILBOLD N J, NG C K S, et al.Large-scale monoclonal antibody purification by continuous chromatography, from process design to scale-up[J].Journal of biotechnology, 2015, 213:65-73.
[33] HARDICK O, DODS S, STEVENS B, et al.Nanofiber adsorbents for high productivity continuous downstream processing[J].Journal of biotechnology, 2015, 213:74-82.
[34] CUNHA B, AGULAR T, SLIVA M M, et al.Exploring continuous and integrated strategies for the up-and downstream processing of human mesenchymal stem cells[J].Journal of biotechnology, 2015, 213 (8) :97-108.
[35] KLUTZ S, MAGNUS J, LOBEDANN M, et al.Developing the biofacility of the future based on continuous processing and single-use technology[J].Journal of biotechnology, 2015, 213:120-130.
[36] MIOTTO M, GOUVEIA R, ABIDIN F Z, et al.Developing a continuous bioprocessing approach to stromal cell manufacture[J].ACS applied materials&interfaces, 2017, 9 (47) :41131-41142.
[37] PATIL R, WALTHER J.Continuous manufacturing of recombinant therapeutic proteins:upstream and downstream technologies[C]//Springer.Advances in Biochemical Engineering/Biotechnology, Berlin:Springer, 2017:1-46
[38] KONSTAINOV K B, COONEY C L.White paper on continuous bioprocessing May 20-21 2014continuous manufacturing symposium[J].Journal of pharmaceutical sciences, 2015, 104 (3) :813-820.
[39] ZYDNEY A L.Perspectives on integrated continuous bioprocessing-opportunities and challenges[J].Current opinion in chemical engineering, 2015, 10:8-13.
[40] DORVIGNIT D, PALACIOS J L, MERINO M, et al.Expression and biological characterization of an anti-CD20biosimilar candidate antibody:a case study[J].Mabs, 2012, 4 (4) :488-496.
[41] CROUGHAN M S, KONSTANTINOV K B, COONEY C.The future of industrial bioprocessing:batch or continuous?[J].Biotechnology and bioengineering, 2015, 112 (4) :648-651.
[42] MERCIER S M, ROUEL P M, LEBRUN P, et al.Process analytical technology tools for perfusion cell culture[J].Engineering in life sciences, 2016, 16 (1) :25-35.


 专科论文咨询
专科论文咨询
